前沿病例 | 风暴的开端与终结
发布时间:2024-12-02

引言
如何在肿瘤化疗后骨髓抑制、血小板减少、凝血功能、肝功能异常等高风险情况下进行有效的抗感染和血液净化治疗,是我们面临的重大挑战之一。今天我们将探讨两例血液肿瘤化疗后骨髓抑制合并脓毒性休克患者的诊疗经历,这两位患者在短时间内经历了由感染诱发的多种细胞因子大量释放(IL-6水平高达1.3×108pg/ml,超过流式细胞计量术检测上限),导致全身性系统性炎症反应——细胞因子风暴综合征,应用细胞因子吸附柱进行血浆吸附治疗,可快速控制失衡的细胞因子,纠正脓毒性休克状态,为患者赢得生机。

病例一 中元节的“风暴”
病情介绍
01

患者
54岁,男性,因急性淋巴细胞白血病(T-ALL)接受化疗后出现IV度骨髓抑制和脓毒性休克。
02

现病史
患者急性T淋巴细胞白血病(T-ALL),化疗后出现骨髓抑制,腹泻,发热,2024年8月17日14:10出现脓毒性休克,血液科医师给予液体复苏、升级抗生素、去甲肾上腺素升压对症。17:05患者突发意识丧失,压眶无反应,血压、血氧进行性下降,血压最低50/30mmHg,血氧饱和度65%,予10L/min吸氧,维持去甲肾上腺素1.0ug/kg/min,转往重症医学科进一步抢救治疗。
03

入院查体
患者嗜睡,查体:体温38.5℃,心率146次/分,血压54/32mmHg,血氧饱和度SpO2 97%,肢端湿冷,心音有力,心律齐,腹软,肠鸣音1-2次/分,双下肢不肿。
04

辅助检查
血气分析: 静脉-动脉血二氧化碳分压差(Pcv-aCO2) 6.5mmHg,中心静脉血氧饱和度(ScvO2) 64%,碱剩余:-9mmol/L;碳酸氢根:14.4mmol/L;氧饱和度:100%;PH校正值:7.435;二氧化碳分压校正值:21.9mmHg;氧分压校正值:168mmHg;
乳酸:8.7mmol/L
血常规:血红蛋白:49g/L;白细胞计数:0.02×109/L;血小板计数:9×109/L;
降钙素原检测:15.85ng/mL;白介素6:> 5500.0pg/ml;
心脏标志物:B-型钠尿肽:155.99pg/mL;肌钙蛋白-I:824.01pg/mL;肌酸激酶:25U/L;
肾功能:肌酐:78umol/L;尿酸:249umol/L;尿素:11.0mmol/L;
凝血功能:凝血酶原时间:20.0秒;凝血酶原标准化比值:1.66;血浆凝血酶原活动度:46.0%;活化部分凝血活酶时间:54.3秒;纤维蛋白原含量:2.030g/L;D-二聚体测定:3272.59ng/ml;
白蛋白:24.3g/L;总胆固醇:1.44mmol/L;甘油三酯:2.40mmol/L;
复查骨穿并无急性淋巴细胞白血病复发情况。
05

影像学检查
颅脑CT:未见明显出血。
胸部CT:未见明显炎症。
腹部超声检查:未见明显积液,胆囊增大。
诊治过程
01

诊断
急性淋巴细胞白血病,化疗后骨髓抑制,脓毒性休克,细胞因子风暴综合征,心肌损害,急性肾损伤,凝血功能异常、低纤维蛋白原血症、血小板减少、重度贫血、高脂血症、高胆红素血症,乳酸性酸中毒、低蛋白血症、电解质代谢紊乱。
02

治疗方案
① 紧急气管插管保护气道,呼吸机控制通气。
② 强化镇痛,适当镇静,降低组织耗氧。
③ 粒缺伴发热,脓毒症休克,予积极广谱联合抗感染治疗。
④ 维持评估容量反应性,升压,维持生命体征。
⑤ 补充白蛋白;预约红细胞、血小板输注。
03

针对患者细胞因子风暴综合征
予血液/血浆吸附(HA/PA)
患者急性淋巴细胞白血病化疗后骨髓抑制并发脓毒性休克,白介素-6检测稀释10倍标本远大于最高值5500pg/ml,伴有多脏器损害包括心脏、血液、呼吸、神经系统,符合细胞因子风暴综合征,根据CTCAE5.0分级为4级。此时患者依靠大剂量血管活性药物维持血压,肌钙蛋白进行性升至1542.4pg/ml,同时此时血小板只有3×109g/L。
根据第30届急性疾病质量倡议(ADQI)工作组共识报告,有充分的理论证据支持临床使用血液吸附(HA),血浆吸附(PA)属于血液吸附统称之内。人体因细胞受伤、感染、药物毒物中毒等原因体内产生毒素,而血液吸附可清除这些毒素,且血液吸附在临床显示出良好的生物相容性、安全性、技术可行性[1]。因患者血小板过低,中元节放假期间无法采集血小板输注,血液净化出血风险高,于是我们应用血细胞分离单采血浆分离后,进行血浆细胞因子吸附,调控细胞因子水平,同时减少对血小板的损耗。
04

治疗效果
8月17日患者休克时白介素6(IL-6)水平高达1.3×108 pg/ml(流式细胞检测方法最高值),于当天使用细胞因子吸附柱进行血浆吸附治疗,2次治疗后患者IL-6水平降至5283.3 pg/ml,4次治疗后降至482.4 pg/ml。肌钙蛋白I(TnI)由转入时的824.01pg/ml降至8月22日的112.25pg/ml。
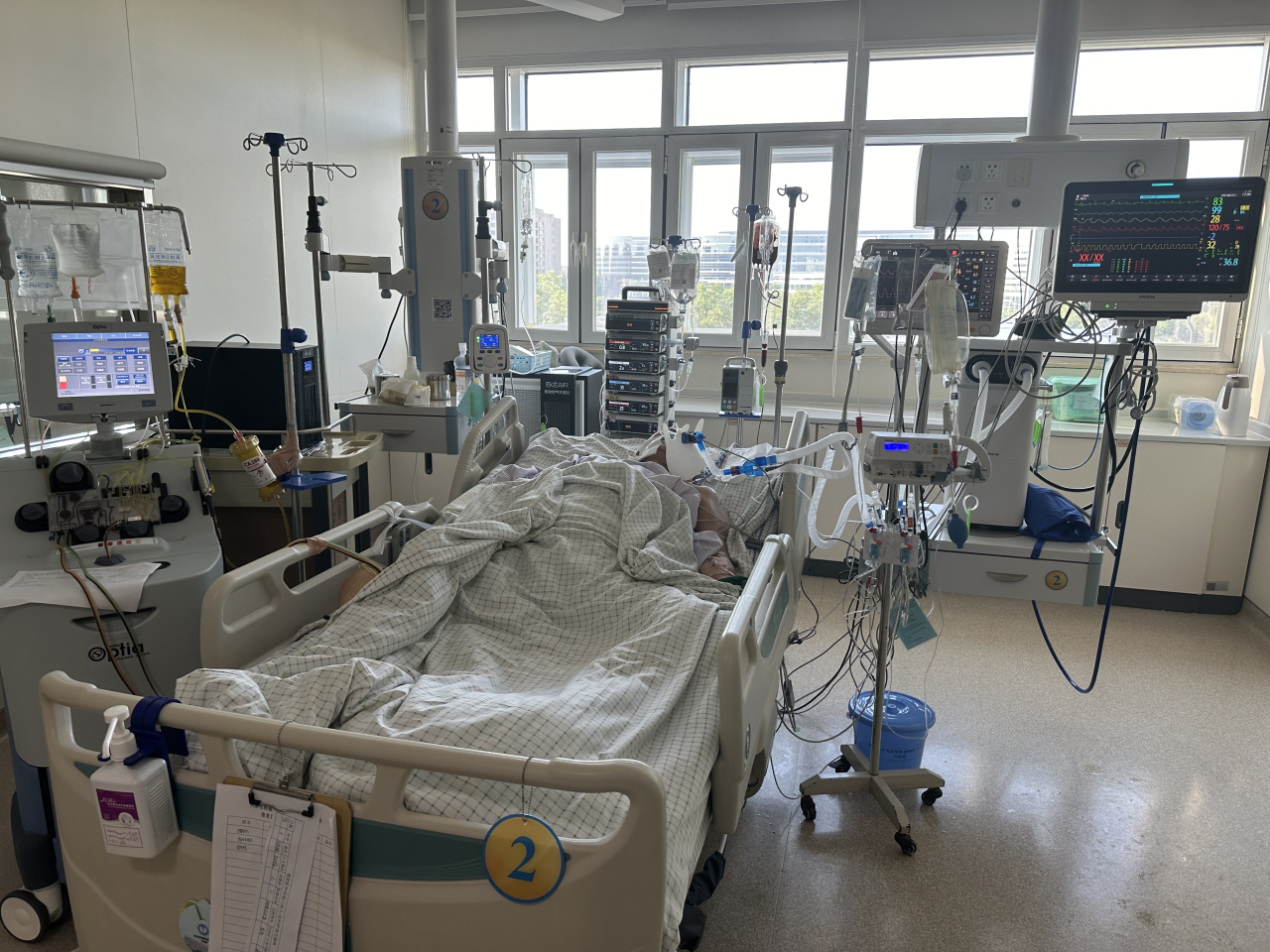
图1 使用CA细胞因子吸附柱进行血浆吸附治疗
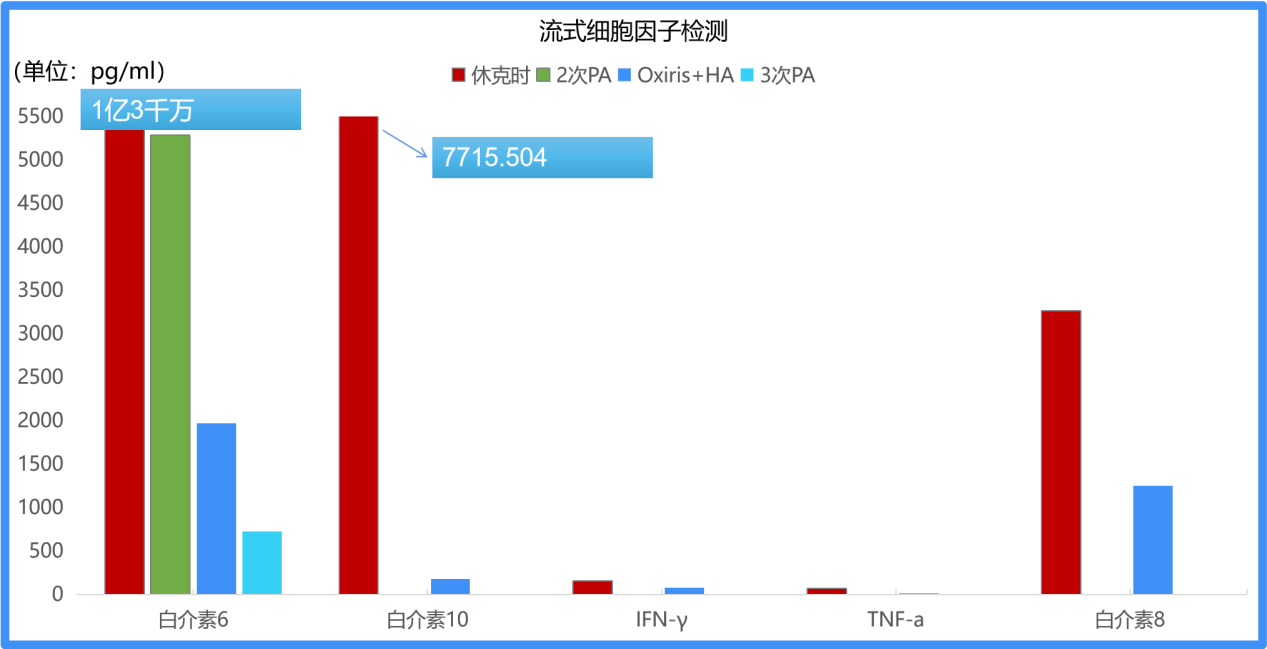
图2 患者细胞因子检测结果
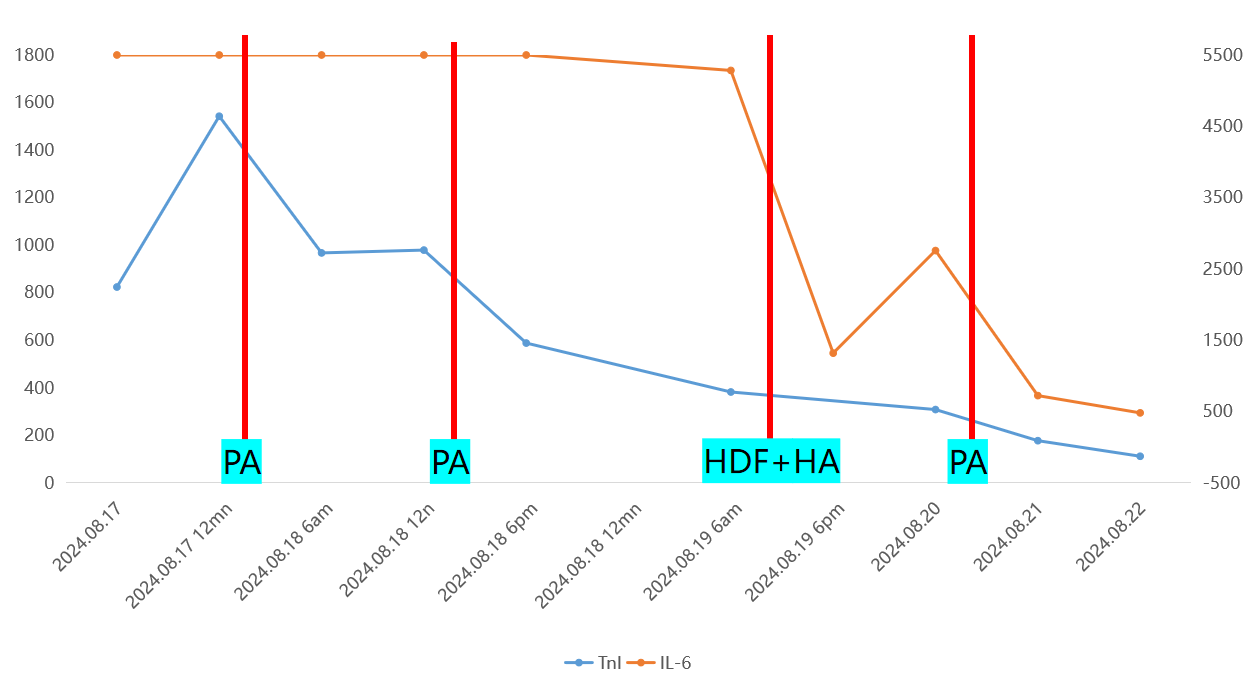
图3 患者IL-6及TnI治疗前后变化
(前2次PA治疗细胞因子过高未能显示在本图数值中)
由于患者存在肝损伤,总胆红素(TBIL)持续升高,于9月2日启动双重血浆分子吸附系统(DPMAS)治疗。治疗后患者TBIL由214.9μmol/L降至124.4μmol/L。
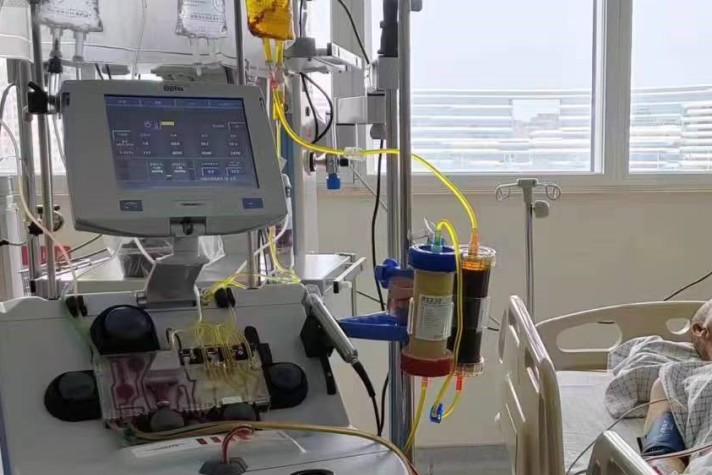
图4 患者接受双重血浆分子吸附系统(DPMAS)治疗
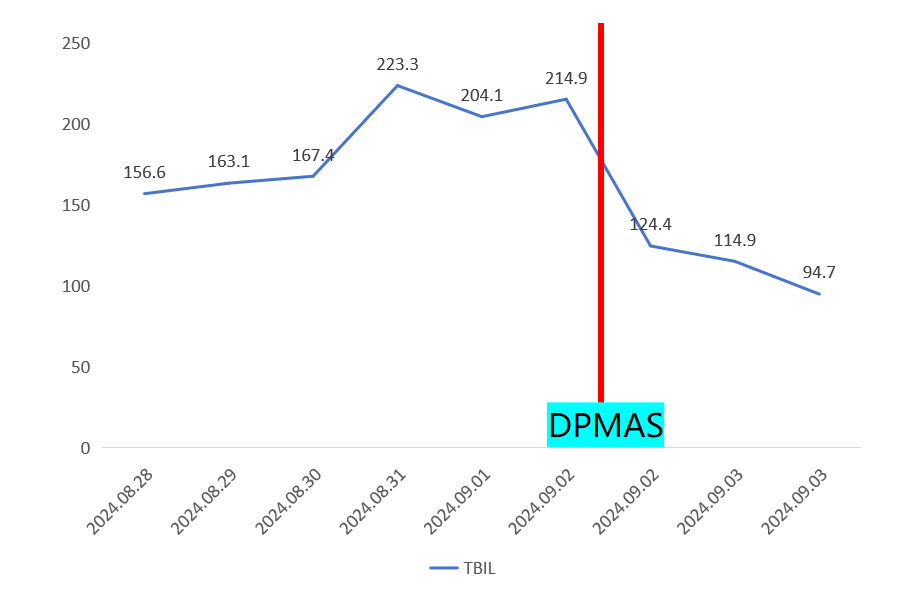
图5 患者TBIL治疗前后变化
05

患者血液吸附的终点选择
终点选择原则:根据研发阶段、临床适应症、血液吸附特性以及预期患者群体选择替代终点(生物标志物)或临床终点。该患者脓毒性休克纠正,血管活性药物减停,PCT、白介素6持续下降,已达到治疗目的,停止血液吸附。
IV度骨髓抑制伴发热患者常难以找到感染灶,因此多以经验性抗感染治疗为主。该患者经抗感染、血液净化、血浆吸附等治疗1周后粒细胞缺乏回复,2周后血小板回复,骨髓抑制自此控制。后续超声、CT检查可疑胆道存在感染,因此完善经内镜逆行胰胆管造影(ERCP)检查提示胆管存在泥沙样结石堵塞胆道,考虑患者存在胆道逆行感染导致脓毒性休克,予置入支架,从而真正明确感染灶。患者因本次急病过程,无法承受第3次化疗,因此更无法移植,家属综合考虑疾病、经济、家庭等因素后自动出院。
通过这例病人的治疗,让我们收获总结了一定的针对该类病人的经验。于是后续再次出现的病人我们在治疗上进行了进一步的调整。
病例二 国庆节的“风暴”
病情介绍
01

患者
55岁,男性,因套细胞淋巴瘤,异基因移植术后发热3天,考虑脓毒性休克转入ICU。
02

现病史
患者套细胞淋巴瘤,2024年6月18日干细胞移植后(子供父),09月27日出现咽痛,体温升高,病人未予重视,2024-09-30 16:15入院,入院体温38.9℃,血压低,最低70/40mmHg后转入ICU。
03

入院查体
患者嗜睡,查体:体温38.5℃,心率142次/分,血压70/42mmHg,SpO2 97%,肢端湿冷,神清,心音有力,心律齐,腹软,肠鸣音1-2次/分,双下肢不肿。去甲肾上腺素已加量至1.6ug/kg/min升压。
04

辅助检查
血气分析:Pcv-aCO2 8.4mmHg,ScvO2 54%,碱剩余:-8mmol/L;碳酸氢根:16.4mmol/L;总二氧化碳:17mmol/L;氧饱和度:97%;PH校正值:7.417;二氧化碳分压校正值:25.9mmHg
乳酸:5.7mmol/L
肝肾功能:丙氨酸氨基转移酶:14U/L;天门冬氨酸氨基转移酶:14U/L;总胆红素:14.7umol/L;直接胆红素:14.8umol/L;葡萄糖:4.65mmol/L;钾:4.2mmol/L;钠:132mmol/L;氯:104mmol/L;镁:0.68mmol/L;
降钙素原检测:32.90ng/mL;白介素6:> 5500.0pg/ml;
心脏标志物:B-型钠尿肽:127.53pg/mL;肌钙蛋白-I:77.38pg/mL;
肾功能:肌酐(酶法):153umol/L;尿酸:247umol/L;尿素:14.8mmol/L;
凝血功能:凝血酶原时间:14.4秒;凝血酶原标准化比值:1.10;血浆凝血酶原活动度:84.0%;活化部分凝血活酶时间:34.6秒;纤维蛋白原含量:4.680g/L;凝血酶时间:15.7秒;D-二聚体测定:968.28ng/ml(FEU);
血常规:红细胞计数:1.94×1012/L;血红蛋白:66g/L;红细胞容积:19.0%;白细胞计数:0.57×109/L;血小板计数:22×109/L。
诊治过程
01

诊断
套细胞淋巴瘤、化疗后骨髓抑制,脓毒性休克、肺炎、急性肾损伤、心动过速、心肌损害、低蛋白血症、贫血、血小板减少、低蛋白血症、造血干细胞移植状态。
02

血浆吸附治疗
我们再次寻求文献证据,在面对新冠病毒肺炎细胞因子风暴推荐使用高度生物相容性的中性大孔吸附树脂的血液灌流器进行HP治疗,旨在清除循环系统中的过量细胞因子,在血液动力学支持和器官功能恢复方面具有显著优势。推荐使用方案为HA血液灌流器的2-1-1治疗方案,即前24小时内使用2支灌流器,随后2天每天使用1支灌流器[2]。而该细胞因子风暴综合征患者,在发病时已达病情最重时刻,因此我们直接在应用1.6ug/kg/min去甲肾上腺素的同时,应用2个细胞因子吸附柱进行血浆吸附。
03

治疗效果
9月30日患者休克时白介素6(IL-6)水平再次高达1.3×108 pg/ml(流式细胞检测方法最高值),于当天将2个细胞因子吸附柱串联使用进行血浆吸附治疗,治疗后患者IL-6水平降至1797.2 pg/ml,第二次治疗后降至587 pg/ml。去甲肾上腺素同时逐渐减停(血管活性药物调节时间过程见图8)。
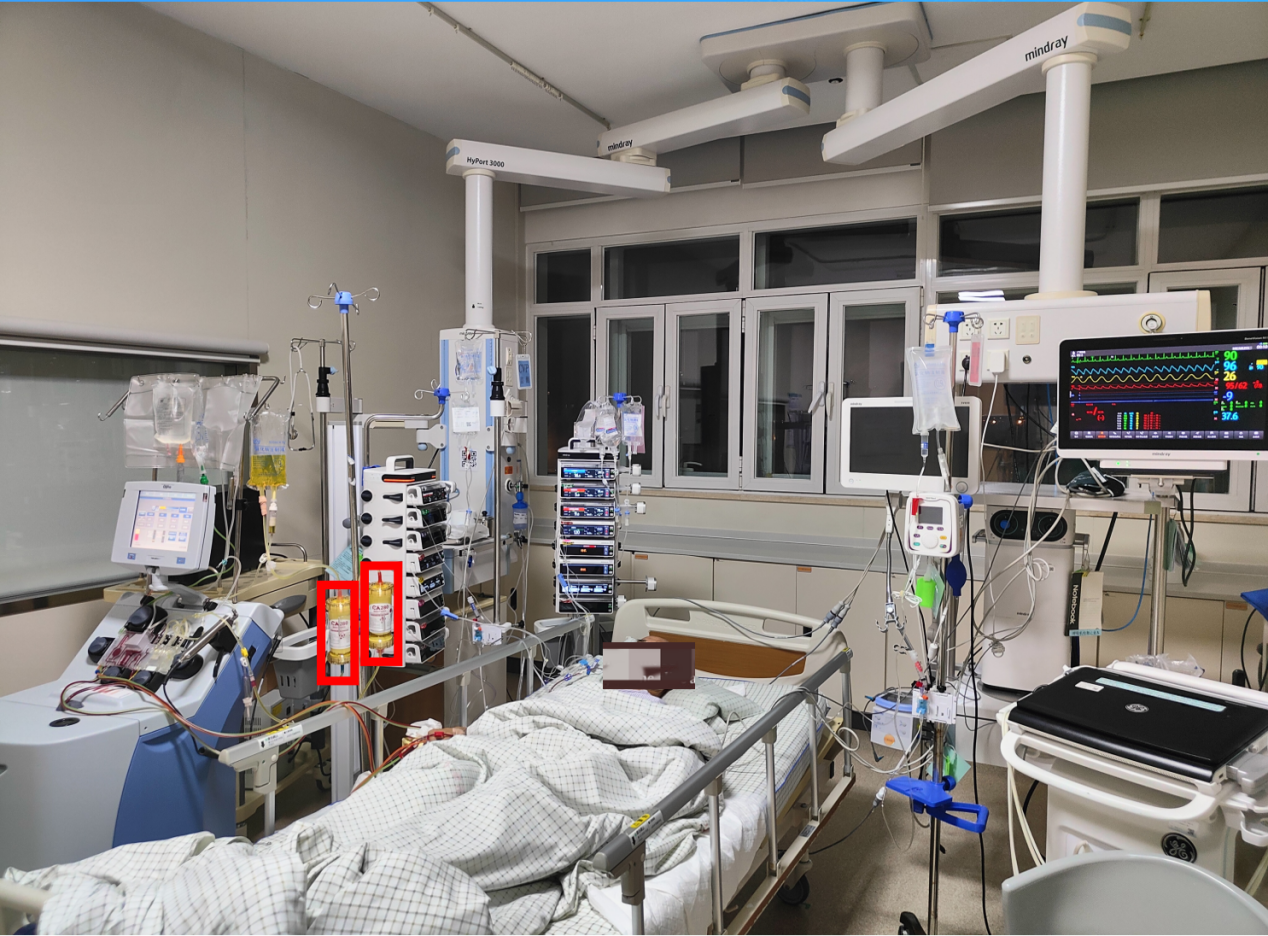
图6 患者接受CA细胞因子吸附治疗
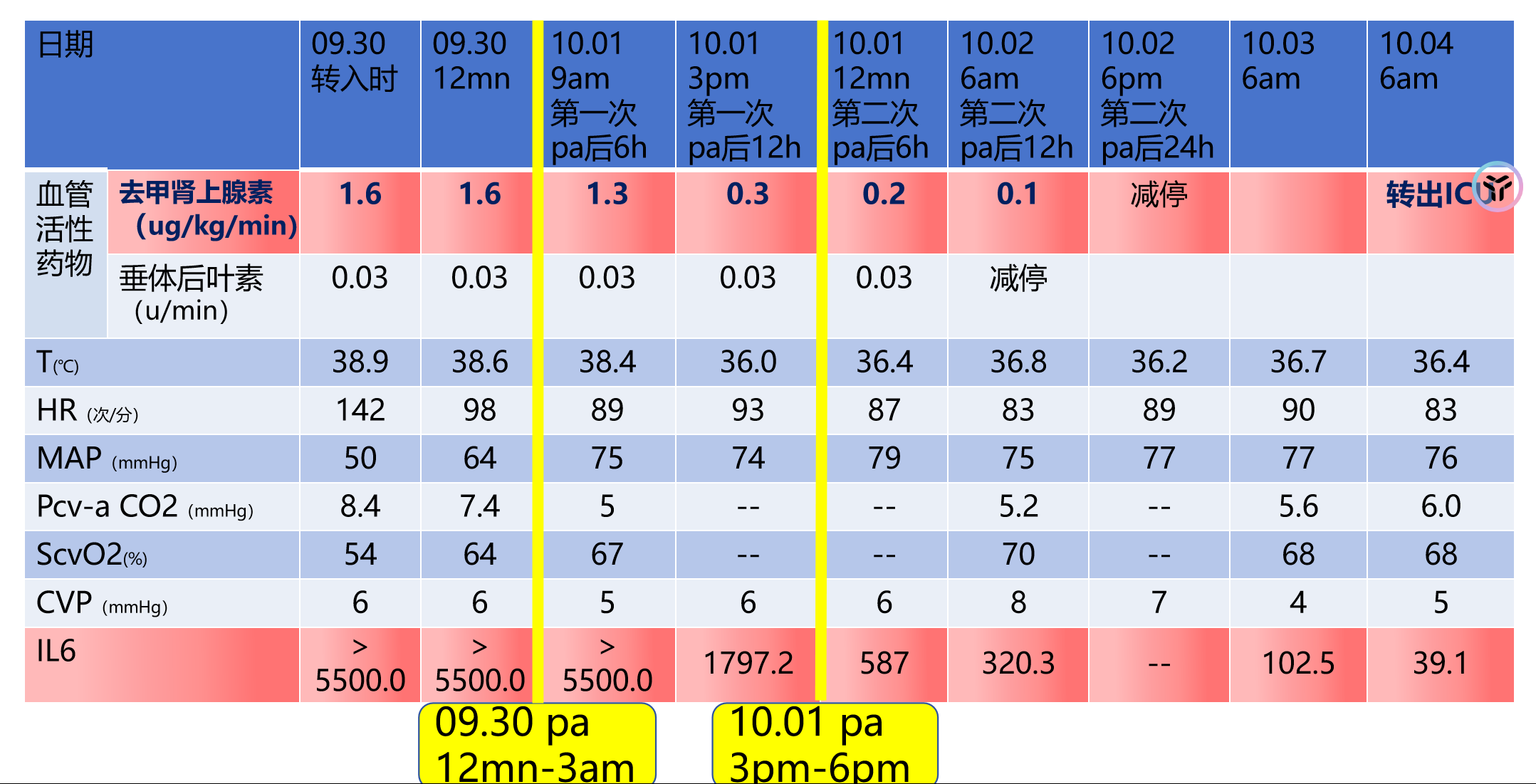
图7 患者生命体征结果
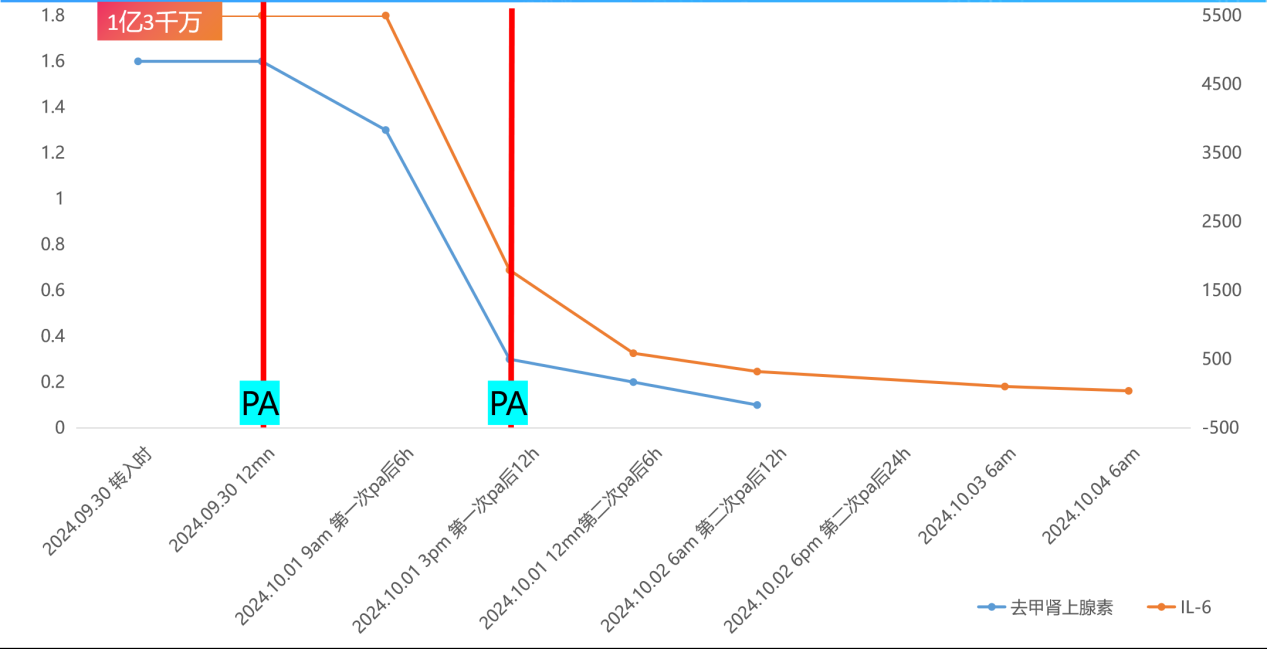
图8 患者IL-6及去甲肾上腺素治疗前后变化
(第1次PA治疗细胞因子过高未能显示在本图数值中)
2天、4支吸附柱、4小时,能够更快地调节细胞因子水平,纠正休克,未做CRRT。肺泡灌洗液病原微生物基因检测结果提示卡氏肺孢子菌肺炎,予磺胺、卡泊芬净联合抗感染治疗。患者4天血压、肾功能恢复,脱离呼吸机转出ICU。
病例总结
两例患者均出现化疗后骨髓抑制合并脓毒性休克,流式细胞计量术检测细胞因子明显升高(IL-6均超过检测上限1亿3千万),伴有多脏器损害,后续检查证实为胆管炎和重症肺炎诱发细胞因子风暴综合征。化疗后免疫力极度低下的血液系统肿瘤患者,可能出现放大化的细胞因子风暴综合征,心肌损害、凝血功能障碍以及胆汁淤积均可由此解释。
细胞因子吸附治疗可无差别控制失衡的细胞因子、改善血流动力学,纠正脓毒性休克状态,甚至避免进一步血液透析滤过治疗。无需完全控制细胞因子至正常范围,血流动力学状态稳定即可停止血浆吸附。
与连续血液净化相比,血浆吸附治疗对于严重血小板减少及凝血功能异常患者安全性良好,对血小板及凝血功能影响小。根据体外试验结果,血浆细胞因子吸附治疗2小时即可达到最大化效果,缩短治疗时间进一步减少对抗生素等治疗性药物的血药浓度影响。
细胞因子吸附作为一种新技术,尽管目前对于其开始和结束的最佳时机、2-1-1或是第2例患者的2+2方案以及其对血药浓度和患者预后的影响均没有定论,但我们相信,随着像中元节、国庆节风暴这样更多临床危重症患者数据的积累,这一技术将更为成熟完善,能为更多患者带来生机。
*病例来源:天津市肿瘤医院空港医院重症医学科 夏睿 邓跃杨
参考文献:
1. Ghada, Ankawi,Sean M, Bagshaw,Rinaldo, Bellomo et al. Hemoadsorption: Consensus report of the 30th Acute Disease Quality Initiative workgroup.[J] .Nephrol Dial Transplant, 2024, 0: 0.
2. Ronco C, Reis T, De Rosa S. Coronavirus Epidemic and Extracorporeal Therapies in Intensive Care: si vis pacem para bellum. Blood Purif. 2020;49(3):255-258.

引言
如何在肿瘤化疗后骨髓抑制、血小板减少、凝血功能、肝功能异常等高风险情况下进行有效的抗感染和血液净化治疗,是我们面临的重大挑战之一。今天我们将探讨两例血液肿瘤化疗后骨髓抑制合并脓毒性休克患者的诊疗经历,这两位患者在短时间内经历了由感染诱发的多种细胞因子大量释放(IL-6水平高达1.3×108pg/ml,超过流式细胞计量术检测上限),导致全身性系统性炎症反应——细胞因子风暴综合征,应用细胞因子吸附柱进行血浆吸附治疗,可快速控制失衡的细胞因子,纠正脓毒性休克状态,为患者赢得生机。

病例一 中元节的“风暴”
病情介绍
01

患者
54岁,男性,因急性淋巴细胞白血病(T-ALL)接受化疗后出现IV度骨髓抑制和脓毒性休克。
02

现病史
患者急性T淋巴细胞白血病(T-ALL),化疗后出现骨髓抑制,腹泻,发热,2024年8月17日14:10出现脓毒性休克,血液科医师给予液体复苏、升级抗生素、去甲肾上腺素升压对症。17:05患者突发意识丧失,压眶无反应,血压、血氧进行性下降,血压最低50/30mmHg,血氧饱和度65%,予10L/min吸氧,维持去甲肾上腺素1.0ug/kg/min,转往重症医学科进一步抢救治疗。
03

入院查体
患者嗜睡,查体:体温38.5℃,心率146次/分,血压54/32mmHg,血氧饱和度SpO2 97%,肢端湿冷,心音有力,心律齐,腹软,肠鸣音1-2次/分,双下肢不肿。
04

辅助检查
血气分析: 静脉-动脉血二氧化碳分压差(Pcv-aCO2) 6.5mmHg,中心静脉血氧饱和度(ScvO2) 64%,碱剩余:-9mmol/L;碳酸氢根:14.4mmol/L;氧饱和度:100%;PH校正值:7.435;二氧化碳分压校正值:21.9mmHg;氧分压校正值:168mmHg;
乳酸:8.7mmol/L
血常规:血红蛋白:49g/L;白细胞计数:0.02×109/L;血小板计数:9×109/L;
降钙素原检测:15.85ng/mL;白介素6:> 5500.0pg/ml;
心脏标志物:B-型钠尿肽:155.99pg/mL;肌钙蛋白-I:824.01pg/mL;肌酸激酶:25U/L;
肾功能:肌酐:78umol/L;尿酸:249umol/L;尿素:11.0mmol/L;
凝血功能:凝血酶原时间:20.0秒;凝血酶原标准化比值:1.66;血浆凝血酶原活动度:46.0%;活化部分凝血活酶时间:54.3秒;纤维蛋白原含量:2.030g/L;D-二聚体测定:3272.59ng/ml;
白蛋白:24.3g/L;总胆固醇:1.44mmol/L;甘油三酯:2.40mmol/L;
复查骨穿并无急性淋巴细胞白血病复发情况。
05

影像学检查
颅脑CT:未见明显出血。
胸部CT:未见明显炎症。
腹部超声检查:未见明显积液,胆囊增大。
诊治过程
01

诊断
急性淋巴细胞白血病,化疗后骨髓抑制,脓毒性休克,细胞因子风暴综合征,心肌损害,急性肾损伤,凝血功能异常、低纤维蛋白原血症、血小板减少、重度贫血、高脂血症、高胆红素血症,乳酸性酸中毒、低蛋白血症、电解质代谢紊乱。
02

治疗方案
① 紧急气管插管保护气道,呼吸机控制通气。
② 强化镇痛,适当镇静,降低组织耗氧。
③ 粒缺伴发热,脓毒症休克,予积极广谱联合抗感染治疗。
④ 维持评估容量反应性,升压,维持生命体征。
⑤ 补充白蛋白;预约红细胞、血小板输注。
03

针对患者细胞因子风暴综合征
予血液/血浆吸附(HA/PA)
患者急性淋巴细胞白血病化疗后骨髓抑制并发脓毒性休克,白介素-6检测稀释10倍标本远大于最高值5500pg/ml,伴有多脏器损害包括心脏、血液、呼吸、神经系统,符合细胞因子风暴综合征,根据CTCAE5.0分级为4级。此时患者依靠大剂量血管活性药物维持血压,肌钙蛋白进行性升至1542.4pg/ml,同时此时血小板只有3×109g/L。
根据第30届急性疾病质量倡议(ADQI)工作组共识报告,有充分的理论证据支持临床使用血液吸附(HA),血浆吸附(PA)属于血液吸附统称之内。人体因细胞受伤、感染、药物毒物中毒等原因体内产生毒素,而血液吸附可清除这些毒素,且血液吸附在临床显示出良好的生物相容性、安全性、技术可行性[1]。因患者血小板过低,中元节放假期间无法采集血小板输注,血液净化出血风险高,于是我们应用血细胞分离单采血浆分离后,进行血浆细胞因子吸附,调控细胞因子水平,同时减少对血小板的损耗。
04

治疗效果
8月17日患者休克时白介素6(IL-6)水平高达1.3×108 pg/ml(流式细胞检测方法最高值),于当天使用细胞因子吸附柱进行血浆吸附治疗,2次治疗后患者IL-6水平降至5283.3 pg/ml,4次治疗后降至482.4 pg/ml。肌钙蛋白I(TnI)由转入时的824.01pg/ml降至8月22日的112.25pg/ml。

图1 使用CA细胞因子吸附柱进行血浆吸附治疗

图2 患者细胞因子检测结果

图3 患者IL-6及TnI治疗前后变化
(前2次PA治疗细胞因子过高未能显示在本图数值中)
由于患者存在肝损伤,总胆红素(TBIL)持续升高,于9月2日启动双重血浆分子吸附系统(DPMAS)治疗。治疗后患者TBIL由214.9μmol/L降至124.4μmol/L。

图4 患者接受双重血浆分子吸附系统(DPMAS)治疗

图5 患者TBIL治疗前后变化
05

患者血液吸附的终点选择
终点选择原则:根据研发阶段、临床适应症、血液吸附特性以及预期患者群体选择替代终点(生物标志物)或临床终点。该患者脓毒性休克纠正,血管活性药物减停,PCT、白介素6持续下降,已达到治疗目的,停止血液吸附。
IV度骨髓抑制伴发热患者常难以找到感染灶,因此多以经验性抗感染治疗为主。该患者经抗感染、血液净化、血浆吸附等治疗1周后粒细胞缺乏回复,2周后血小板回复,骨髓抑制自此控制。后续超声、CT检查可疑胆道存在感染,因此完善经内镜逆行胰胆管造影(ERCP)检查提示胆管存在泥沙样结石堵塞胆道,考虑患者存在胆道逆行感染导致脓毒性休克,予置入支架,从而真正明确感染灶。患者因本次急病过程,无法承受第3次化疗,因此更无法移植,家属综合考虑疾病、经济、家庭等因素后自动出院。
通过这例病人的治疗,让我们收获总结了一定的针对该类病人的经验。于是后续再次出现的病人我们在治疗上进行了进一步的调整。
病例二 国庆节的“风暴”
病情介绍
01

患者
55岁,男性,因套细胞淋巴瘤,异基因移植术后发热3天,考虑脓毒性休克转入ICU。
02

现病史
患者套细胞淋巴瘤,2024年6月18日干细胞移植后(子供父),09月27日出现咽痛,体温升高,病人未予重视,2024-09-30 16:15入院,入院体温38.9℃,血压低,最低70/40mmHg后转入ICU。
03

入院查体
患者嗜睡,查体:体温38.5℃,心率142次/分,血压70/42mmHg,SpO2 97%,肢端湿冷,神清,心音有力,心律齐,腹软,肠鸣音1-2次/分,双下肢不肿。去甲肾上腺素已加量至1.6ug/kg/min升压。
04

辅助检查
血气分析:Pcv-aCO2 8.4mmHg,ScvO2 54%,碱剩余:-8mmol/L;碳酸氢根:16.4mmol/L;总二氧化碳:17mmol/L;氧饱和度:97%;PH校正值:7.417;二氧化碳分压校正值:25.9mmHg
乳酸:5.7mmol/L
肝肾功能:丙氨酸氨基转移酶:14U/L;天门冬氨酸氨基转移酶:14U/L;总胆红素:14.7umol/L;直接胆红素:14.8umol/L;葡萄糖:4.65mmol/L;钾:4.2mmol/L;钠:132mmol/L;氯:104mmol/L;镁:0.68mmol/L;
降钙素原检测:32.90ng/mL;白介素6:> 5500.0pg/ml;
心脏标志物:B-型钠尿肽:127.53pg/mL;肌钙蛋白-I:77.38pg/mL;
肾功能:肌酐(酶法):153umol/L;尿酸:247umol/L;尿素:14.8mmol/L;
凝血功能:凝血酶原时间:14.4秒;凝血酶原标准化比值:1.10;血浆凝血酶原活动度:84.0%;活化部分凝血活酶时间:34.6秒;纤维蛋白原含量:4.680g/L;凝血酶时间:15.7秒;D-二聚体测定:968.28ng/ml(FEU);
血常规:红细胞计数:1.94×1012/L;血红蛋白:66g/L;红细胞容积:19.0%;白细胞计数:0.57×109/L;血小板计数:22×109/L。
诊治过程
01

诊断
套细胞淋巴瘤、化疗后骨髓抑制,脓毒性休克、肺炎、急性肾损伤、心动过速、心肌损害、低蛋白血症、贫血、血小板减少、低蛋白血症、造血干细胞移植状态。
02

血浆吸附治疗
我们再次寻求文献证据,在面对新冠病毒肺炎细胞因子风暴推荐使用高度生物相容性的中性大孔吸附树脂的血液灌流器进行HP治疗,旨在清除循环系统中的过量细胞因子,在血液动力学支持和器官功能恢复方面具有显著优势。推荐使用方案为HA血液灌流器的2-1-1治疗方案,即前24小时内使用2支灌流器,随后2天每天使用1支灌流器[2]。而该细胞因子风暴综合征患者,在发病时已达病情最重时刻,因此我们直接在应用1.6ug/kg/min去甲肾上腺素的同时,应用2个细胞因子吸附柱进行血浆吸附。
03

治疗效果
9月30日患者休克时白介素6(IL-6)水平再次高达1.3×108 pg/ml(流式细胞检测方法最高值),于当天将2个细胞因子吸附柱串联使用进行血浆吸附治疗,治疗后患者IL-6水平降至1797.2 pg/ml,第二次治疗后降至587 pg/ml。去甲肾上腺素同时逐渐减停(血管活性药物调节时间过程见图8)。

图6 患者接受CA细胞因子吸附治疗

图7 患者生命体征结果

图8 患者IL-6及去甲肾上腺素治疗前后变化
(第1次PA治疗细胞因子过高未能显示在本图数值中)
2天、4支吸附柱、4小时,能够更快地调节细胞因子水平,纠正休克,未做CRRT。肺泡灌洗液病原微生物基因检测结果提示卡氏肺孢子菌肺炎,予磺胺、卡泊芬净联合抗感染治疗。患者4天血压、肾功能恢复,脱离呼吸机转出ICU。
病例总结
两例患者均出现化疗后骨髓抑制合并脓毒性休克,流式细胞计量术检测细胞因子明显升高(IL-6均超过检测上限1亿3千万),伴有多脏器损害,后续检查证实为胆管炎和重症肺炎诱发细胞因子风暴综合征。化疗后免疫力极度低下的血液系统肿瘤患者,可能出现放大化的细胞因子风暴综合征,心肌损害、凝血功能障碍以及胆汁淤积均可由此解释。
细胞因子吸附治疗可无差别控制失衡的细胞因子、改善血流动力学,纠正脓毒性休克状态,甚至避免进一步血液透析滤过治疗。无需完全控制细胞因子至正常范围,血流动力学状态稳定即可停止血浆吸附。
与连续血液净化相比,血浆吸附治疗对于严重血小板减少及凝血功能异常患者安全性良好,对血小板及凝血功能影响小。根据体外试验结果,血浆细胞因子吸附治疗2小时即可达到最大化效果,缩短治疗时间进一步减少对抗生素等治疗性药物的血药浓度影响。
细胞因子吸附作为一种新技术,尽管目前对于其开始和结束的最佳时机、2-1-1或是第2例患者的2+2方案以及其对血药浓度和患者预后的影响均没有定论,但我们相信,随着像中元节、国庆节风暴这样更多临床危重症患者数据的积累,这一技术将更为成熟完善,能为更多患者带来生机。
*病例来源:天津市肿瘤医院空港医院重症医学科 夏睿 邓跃杨
参考文献:
1. Ghada, Ankawi,Sean M, Bagshaw,Rinaldo, Bellomo et al. Hemoadsorption: Consensus report of the 30th Acute Disease Quality Initiative workgroup.[J] .Nephrol Dial Transplant, 2024, 0: 0.
2. Ronco C, Reis T, De Rosa S. Coronavirus Epidemic and Extracorporeal Therapies in Intensive Care: si vis pacem para bellum. Blood Purif. 2020;49(3):255-258.



